Un outil précieux
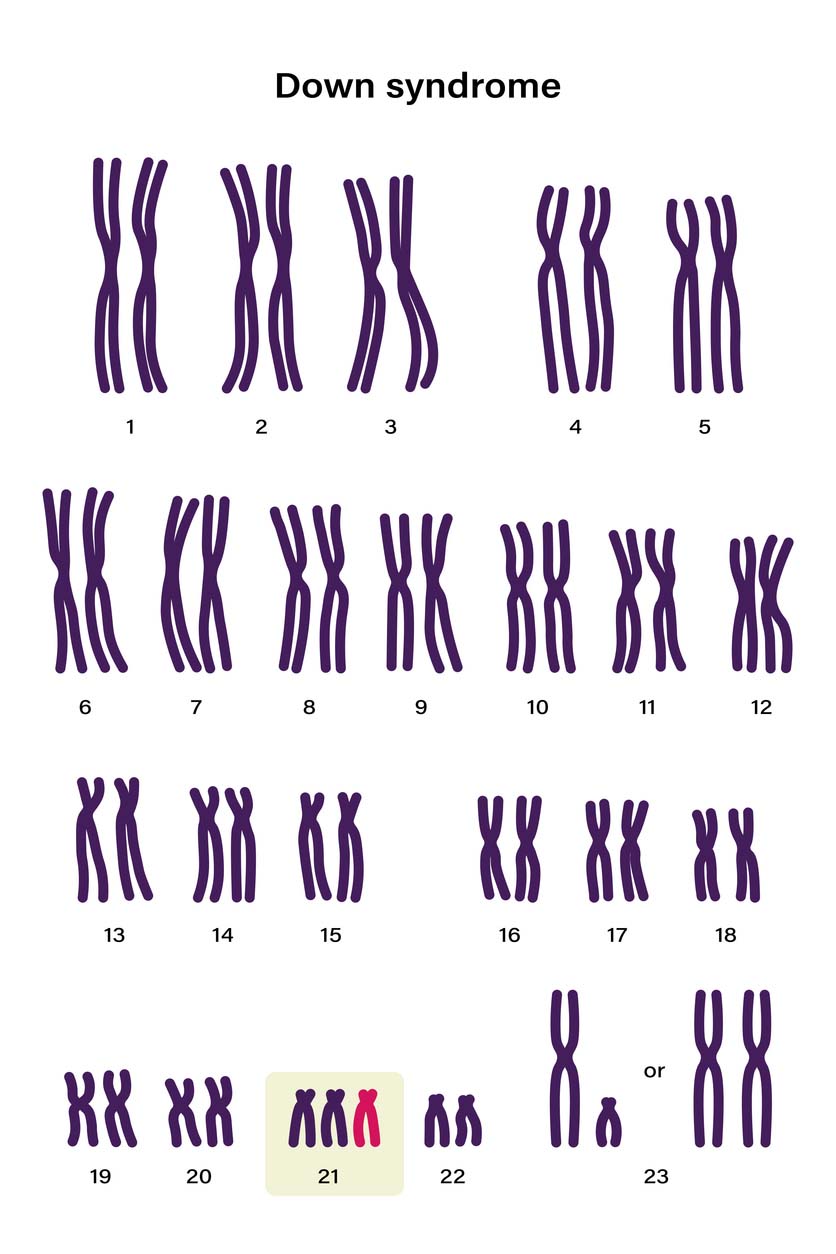
Les tests génétiques préimplantatoires, ou diagnostic génétique préimplantatoire (DPI), représentent des outils précieux dans le cadre de la fécondation in vitro (FIV). Ils permettent d’analyser les embryons afin de détecter d’éventuelles anomalies chromosomiques ou génétiques avant leur transfert dans l’utérus.
Certaines de ces anomalies peuvent entraîner des échecs d’implantation, des fausses couches, ou être à l’origine de maladies comme la trisomie 21 ou la mucoviscidose.
Le recours à ces tests n’est pas systématique. En revanche, il peut s’avérer particulièrement utile dans des situations bien précises.
Dans cet article, nous vous proposons une présentation claire et accessible des tests génétiques préimplantatoires. En quoi consistent-ils ? Comment se déroulent-ils ? À qui s’adressent-ils ? Quels sont leurs bénéfices ? Combien coûtent-ils ? Quelles questions soulèvent-ils le plus souvent ?